- Категория
- Новости
Фармацевтические компании Украины выразили свою позицию по внедрению 2D кодирования лекарственных средств
- Дата публикации
- Количество просмотров
-
1401
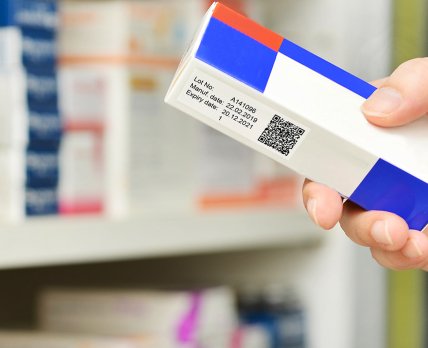
Крупнейшие игроки украинского фармрынка обратились к правительству с просьбой отложить внедрение 2D кодирования упаковок лекарственных средств в Украине.
Украинские фармацевтические компании обратились к Премьер-министру Украины Денису Шмыгалю и Председателю комитета Верховной Рады Украины по вопросам здоровья нации, медицинской помощи и медицинского страхования Михаилу Радуцкому с просьбой пересмотреть сроки внедрения в Украине системы обязательного 2D кодирования лекарственных средств.
К инициативе присоединились более 10 компаний, производящих значительную часть фармацевтической продукции для рынка Украины: «Галичфарм», «Киевмедпрепарат», «Фармак», «Кусум Фарм», «Фармацевтическая фирма Дарница», «Киевский витаминный завод», «Фармацевтическая компания «Здоровье», Опытный завод «ГНЦЛС», «Здоровье Народа», «Фармекс групп», «Борщаговский ХФЗ».
В обращении компании выражают свою поддержку процессов гармонизации украинского законодательства и нормативных требований законодательства и требований в ЕС, вместе с тем считают целесообразным существенно пересмотреть «Концепцию реализации государственной политики по предотвращению фальсификации лекарственных средств и утверждении плана мероприятий по ее реализации» с учетом опыта ЕС и отложить ее реализацию как минимум до момента преодоления последствий пандемии COVID-19.
В частности, компании отмечают, что при реализации пилотного проекта по маркировке контрольными знаками и проведения мониторинга обращения лекарственных средств стало понятно, что есть риск создания двух параллельных систем 2D-кодирования – украинской и европейской. Производители отмечают также, что не были учтены важные аспекты опыта ЕС, в частности относительно информации, содержащейся в коде. Обязательная маркировка лекарственных средств в текущем виде, как система потребует значительных капитальных инвестиций отечественных производителей, а технические разногласия между предлагаемой в Украине и действующей в ЕС системами сериализации не будут способствовать увеличению экспорта отечественных лекарств в ЕС.
Компании обращаются к другим операторам фармацевтического рынка Украины с призывом присоединиться к данной инициативе о переносе сроков внедрения 2D кодирования в Украине и совместно разработать план внедрения 2D кодирования лекарственных средств для повышения безопасности и качества лекарственных средств для украинских пациентов.
Мы приводим текст открытого письма участников рынка:
Прем’єр-Міністру України
Д.А. Шмигалю
Копія: Голові комітету Верховної Ради України
з питань здоров'я нації, медичної допомоги
та медичного страхування
М.Б. Радуцькому
Щодо неготовності і несвоєчасності
впровадження 2D кодування
лікарських засобів в Україні
Шановний Денисе Анатолійовичу!
Українські фармацевтичні компанії підтримують процеси гармонізації законодавства і регуляторних вимог України до таких у ЄС з метою покращення ефективності, безпеки та якості лікарських засобів для українських пацієнтів.
В 2016 р. в ЄС було опубліковано Керівництво з вимогами до нанесення елементів безпеки на пакувальні матеріали деяких лікарських засобів (Regulation (EU) 2016/161). З 09.02.2019 вони стали обов’язковими в усіх країнах-членах ЄС, крім Італії та Греції (в цих країнах плануються їх впровадження у 2025 р.).
Таким чином, у 2019 р. в ЄС почала працювати система серіалізації та контролю першого розкривання упаковки, тобто нанесення елементів безпеки на упаковки лікарських засобів, як додатковий (до існуючої в ЄС жорсткої регуляторної системи) засіб боротьби з фальсифікацією ліків. Вказане Керівництво встановлює чіткі вимоги до унікальних ідентифікаційних номерів лікарських засобів, що мають бути нанесені на пакувальні матеріали, вимоги до нанесення та якості друку 2D-кодів та системи верифікації елементів безпеки лікарських засобів.
Також в ЄС створена веріфікаційна агенція EMVO, яка відповідає за збір та зберігання інформації щодо продуктів та елементів безпеки, а також містить платформи для перевірки автентичності лікарських засобів кінцевими та проміжними операторами ланцюга поставки (лікарнями, аптеками, дистриб’юторами, тощо). EMVO є недержавною неприбутковою організацією, заснованою європейськими професійними асоціаціями аптек, лікарень, дистриб’юторів та виробників лікарських засобів. Вона фінансується за рахунок членських внесків учасників системи; роль держав та союзних регуляторних органів ЄС полягає у нагляді за роботою EMVO та затверджені відповідних регуляторних документів.
Орієнтуючись на європейський досвід, Кабінет Міністрів України прийняв Розпорядження від 03.04.2019 р. № 301-р., яким схвалив «Концепцію реалізації державної політики щодо запобігання фальсифікації лікарських засобів та затвердження плану заходів з її реалізації». Єдиним завданням документу зазначено створення системи маркування 2D-кодами упаковок препаратів, без згадування будь-яких інших механізмів боротьби з фальсифікацією лікарських засобів. Більше того, так як в ЄС серіалізацію було імплементовано лише в 2019 році, наразі відсутня доказова база ефективності діючої системи, на яку посилається український Уряд.
Проаналізувавши більш прискіпливо європейські підходи, національну Концепцію та положення про відповідний пілотний проект, ми вважаємо за доцільне переглянути вказану Концепцію щодо заходів, відповідальних осіб, технічних вимог до системи, переліку препаратів, на які поширюється вимога щодо серіалізації тощо, а також відтермінувати заплановані в ній строки виконання заходів з наступних причин:
- В тексті «Концепції» вказані некоректні вихідні дані і суттєво завищена кількість випадків та небезпека від фальсифікованих ліків в Україні.
Зокрема, в розділі «Проблема, яка потребує розв’язання» вказано: «За результатами проведених досліджень ВООЗ майже 10,5 відсотка всіх лікарських засобів, що використовуються в країнах з низьким та середнім рівнем доходів, є фальсифікованими.». Оскільки ці данні автори Концепції наводять у цьому розділі, очевидно, що вони так оцінюють рівень фальсифікованих ліків і в Україні.
Насправді, в публікації ВООЗ «A study on the public health and socioeconomic impact of substandard and falsified medical products» (2017) https://www.who.int/medicines/regulation/ssffc/publications/SE-Study_EN_web.pdf?ua=1 (стор.7, останній абзац), звідки була взята ця інформація, цієї цифрою характеризують не кількість фальсифікованих ліків, а суму субстандартних та фальсифікованих продуктів разом. Крім цього,в цій публікації ВООЗ оцінює не кількість ліків, що використовуються пацієнтами, а виявлені серед перевірених зразків: «*The aggregate observed failure rate of tested samples of substandard and falsified medicines in low and middle income countries is approximately 10.5%.»
Субстандартні (неякісні) лікарські засоби – це продукти випущені легальними виробниками, але із відхиленнями від нормативних вимог. Їх кількість в країнах, що не мають жорстких регуляторних вимог (GMP), може на порядок перевищувати кількість фальсифікованих лікарських засобів.
Ще одним некоректним пунктом в тексті «Концепції» є твердження: «Статистичні дані щодо фальсифікації лікарських засобів в Україні фактично відсутні. Неможливість визначення їх обсягів пов’язана з відсутністю єдиної системи моніторингу обігу лікарських засобів.»
Насправді, в Держлікслужбі МОЗ є статистика виявлення фальсифікованих і субстандартних лікарських засобів в Україні з 1999 р. Зокрема, в монографії С.О. Лебедя «Історичні аспекти та сучасний стан фальсифікації лікарських засобів в Україні та світі» (Рівне: Волин. обереги, 2018. – 320 с.) представлена статистика Держінспекції/ Держлікслужби за 1999-2017 рр. і зроблений висновок, що «відсоток субстандартних та підроблених ліків, що виявлялися в Україні, коливається від 0,03 до 0,34 %». Таким чином, в Україні є офіційні фактичні дані по кількість виявлених фальсифікованих лікарських засобах. І хоча вони можуть відрізнятися від реальної кількості підроблених продуктів на ринку, але вони, як мінімум, в 30 разів менші, ніж вказані у «Концепції», затвердженій Розпорядженням КМУ від 03.04.2019 р. № 301-р.
Сумнівною є й теза про те, що проблеми фальсифікації лікарських засобів в Україні можна повністю вирішити шляхом впровадження системи маркування і моніторингу обігу ліків (серіалізації). Оскільки при впроваджені в Україні європейського підходу щодо маркуванням 2D-кодами тільки рецептурних ліків (за виключенням більшості інфузійних розчинів тощо) і одного безрецептурного препарату, та з урахуванням часток рецептурних та безрецептурних препаратів на ринку України (біля 40:60 в упаковках) тільки приблизно третина лікарських засобів в Україні буде мати обов’язкове маркування 2D-кодами. Відповідно, ця система не буде поширюватися на дві третини упаковок ліків на ринку і не зможе запобігати їх фальсифікації.
- В ході реалізації пілотного проекту щодо маркування контрольними (ідентифікаційними) знаками та проведення моніторингу обігу лікарських засобів, затвердженого Постановою КМУ від 24.07.2019 р. № 653, стало зрозуміло, що не було враховано певні важливі аспекти досвіду ЄС щодо:
- технічних характеристик системи моніторингу;
- суті самого коду маркування ліків (зашитої в ньому інформації);
- підходу до організації роботи EMVO;
- часу, реально потрібного на виконання проекту (в ЄС на це пішло більше 5 років), через що заплановані на 2019 рік кроки були прострочені або досі не виконані.
На нашу думку, прийняття КМУ рішень щодо обов’язкового маркування лікарських засобів в Україні в 2021-2023 рр. в поточному розумінні системи потягнуть за собою значні капітальні інвестицій вітчизняних виробників у проектування, впровадження і введення в експлуатацію обладнання для маркуванням ліків 2D-кодами. І, головне, ці інвестиції не зможуть бути використані у зв’язку із недосконалістю пропонованої системи та невиконаннями іншими учасниками проекту своїх зобов’язань (включаючи державні органи влади).
Більше того, наявність технічних розбіжностей між пропонованою в Україні та діючою в ЄС системами серіалізації, скоріше за все, не сприятиме збільшенню експорту вітчизняних ліків до ЄС. Іноземні компанії також неодноразово висловлювали стурбованість, що зважаючи на технічні розбіжності, передусім в суті коду маркування і закладеної у нього інформації, вони не зможуть виконати необхідні умови і стати учасниками пропонованої системи. Фактично, є ризик того, що буде створено дві паралельні системи 2D-кодування – українська та європейська.
- У зв’язку з пандемією COVID-19, що спричинила глобальну економічну кризу, та, відповідно, безпрецедентне падіння об’єму українського фармацевтичного ринку, українські компанії зіткнулися с серйозними економічними проблемами і необхідністю швидко реагувати на нові потреби системи охорони здоров’я.
У зв’язку з цим, пропонуємо суттєво переглянути Концепцію з врахуванням досвіду ЄС щодо технічних, організаційних та процедурних моментів і відкласти її реалізацію щонайменше до моменту подолання наслідків пандемії COVID-19.
Вважаємо, що державним організаціям і всім учасникам ринку у найближчі 2-3 роки краще зосередитися на вирішенні більш актуальних для України проблем фармацевтичного сектору – розвиток програми реімбурсації («Доступні ліки»), удосконалення державних закупівель ліків, їх раціонального використання, відродження системи рецептурного відпуску ліків з аптек, впорядкування е-торгівлі ними, гармонізація процедур реєстрації, ліцензування, вимог до виробництва лікарських засобів з такими в ЄС тощо.
З повагою,
Директор виконавчий
АТ «Галичфарм» Олександр Блонський
Директор виконавчий
АТ «Київмедпрепарат» Олександр Яцюк
Виконавчий директор
АТ «Фармак» Володимир Костюк
Генеральний директор
ТОВ «КУСУМ ФАРМ» Раджив Гупта
Генеральний директор ПрАТ
«Фармацевтична фірма «Дарниця» Андрій Обрізан
Директор
АТ «Київський вітамінний завод» Володимир Телявський
Директор технічний ТОВ
«Фармацевтична компанія «Здоров’я» Андрій Величко
Директор
ТОВ «Дослідний завод «ГНЦЛС» Олена Швінагірь
Директор ТОВ «ХФП
«Здоров'я Народу» Ольга Ловашніченко
Директор виконавчий
ТОВ «Фармекс Груп» Сергій Парубочий
Генеральний директор
ПАТ НВЦ «Борщагівський ХФЗ» Юлія Здаревська
























